2021 — Rapports 1 et 2 du commissaire à l’environnement et au développement durable au Parlement du CanadaRapport 2 — Les produits de santé naturels — Santé Canada
Rapport de l’auditeur indépendant
Table des matières
- Introduction
- Constatations, recommandations et réponses
- L’innocuité et l’efficacité des produits de santé naturels
- Santé Canada n’a pas vérifié si les établissements suivaient les bonnes pratiques de fabrication avant la mise en marché des produits
- Santé Canada a laissé des produits de santé naturels sans surveillance après leur mise en marché et n’a pas toujours réussi à régler les problèmes graves
- La piètre qualité des renseignements communiqués aux consommateurs sur les produits homologués
- La surveillance limitée à l’égard des produits homologués et des fabricants titulaires d’une licence d’exploitation
- La surveillance limitée à l’égard des produits non homologués et des activités non autorisées
- Un succès mitigé dans le règlement de problèmes graves liés à des produits
- Santé Canada a pris des mesures efficaces à l’égard des produits de santé naturels liés à la COVID‑19
- L’innocuité et l’efficacité des produits de santé naturels
- Conclusion
- À propos de l’audit
- Tableau des recommandations
- Pièces :
- 2.1 — Comparaison entre la réglementation des produits de santé naturels, celle des médicaments en vente libre et celle des cosmétiques
- 2.2 — Processus de délivrance d’une licence de mise en marché d’un produit de santé naturel et d’une licence d’exploitation pour la fabrication d’un tel produit
- 2.3 — Santé Canada n’a pas réussi à faire retirer du marché un produit de santé naturel qui contenait des ingrédients pharmaceutiques
Introduction
Information générale
2.1 Les produits de santé naturels sont des produits d’autosoins, faits à partir d’ingrédients naturels, qui sont utilisés pour maintenir une bonne santé en général. Ils comprennent :
- les vitamines, les minéraux et les probiotiques;
- les médicaments homéopathiques;
- les produits de médecine traditionnelle, notamment les remèdes traditionnels chinois et ayurvédiques (Inde orientale), qui sont fondés sur des théories, des croyances et des expériences de différentes cultures et font appel à des pratiques médicales anciennes pour entretenir la santé;
- les produits non traditionnels assortis d’allégations santé, notamment ceux qui affirment favoriser la perte de poids ou le sommeil;
- les désinfectants pour les mains à base d’alcool;
- certains écrans solaires, dentifrices et shampoings comportant des allégations santé.
2.2 Selon un sondage d’opinion mené en 2010 sur les produits de santé naturels, environ 70 % de la population canadienne utilisait régulièrement ce type de produits pour rester en santé et prévenir des problèmes de santé mineurs. Dans un sondage mené en 2016, plus de la moitié des répondants canadiens ont déclaré prendre des vitamines et des minéraux toutes les semaines.
2.3 Parce qu’ils sont formulés à partir d’ingrédients présents dans la nature, les produits de santé naturels sont généralement perçus comme étant sans danger. Or, certains produits naturels peuvent entraîner des effets indésirables lorsqu’ils sont pris avec d’autres médicaments ou si leur mode d’emploi n’est pas respecté. Certains produits de santé naturels, autorisés ou non, ont causé des effets indésirables graves et inattendus, notamment des chocs septiques, des jaunisses et des perturbations du fonctionnement du foie; dans certains cas, ces effets ont nécessité un séjour à l’hôpital.
2.4 C’est en 2004 que les produits de santé naturels ont commencé à être réglementés au Canada. Le gouvernement fédéral voulait trouver un juste équilibre entre, d’une part, la sécurité des consommateurs et, d’autre part, leur liberté de choix et leur accès à des remèdes traditionnels. Pour être vendu au Canada, un produit de santé naturel doit être homologué par Santé Canada, qui en vérifie l’innocuité et l’efficacité. Le Ministère estime qu’un produit de santé naturel est sécuritaire si ses bienfaits l’emportent sur les risques qu’il pose lorsqu’il est utilisé comme prévu et selon les indications du fabricant. Le Ministère juge qu’un produit est efficace lorsque des preuves attestent que le produit apportera les bienfaits décrits dans les allégations qui l’accompagnent. Depuis 2004, Santé Canada a homologué plus de 91 000 produits de santé naturels.
2.5 Les produits de santé naturels sont réglementés différemment des médicaments en vente libre (médicaments vendus sans ordonnance) et des produits cosmétiques (voir la pièce 2.1). Tous ces produits sont vendus sur les mêmes tablettes dans les pharmacies, l’endroit où les consommateurs se les procurent le plus souvent.
Pièce 2.1 — Comparaison entre la réglementation des produits de santé naturels, celle des médicaments en vente libre et celle des cosmétiques
| Produits de santé naturels | Médicaments en vente libre | Cosmétiques | |
|---|---|---|---|
| Ingrédients acceptés | Ingrédients naturels, extraits de ces ingrédients et duplicats synthétiques | Ingrédients synthétiques seulement | Ingrédients naturels ou synthétiques |
| Allégations santé autorisées par Santé Canada | Soulagement des douleurs et des symptômes, traitement de certaines maladies | Soulagement des douleurs et des symptômes, traitement de certaines maladies | Aucune |
| Preuves exigées pour attester de l’innocuité et de l’efficacité du produit | Preuves scientifiques et éléments probants émanant de pratiques de médecine traditionnelle ou homéopathique | Preuves scientifiques | Des preuves peuvent être demandées |
| Santé Canada est avisé lorsque le produit est mis sur le marché | Non | Oui | Oui |
| Santé Canada peut exiger un rappel du produit | Non | Oui | Non |
| Santé Canada impose des frais pour la demande d’homologation | Non | Oui : de 1 616 $ à 400 288 $ | Non |
| Amende imposée par Santé Canada en cas d’infraction à la loi | Maximum de 5 000 $ | Maximum de 5 000 000 $ | Maximum de 5 000 $ |
2.6 Santé Canada est chargé d’assurer la gestion du Règlement sur les produits de santé naturels, qui vise à garantir l’innocuité et l’efficacité des produits de santé naturels. Avant la mise sur le marché d’un produit, le Ministère doit homologuer le produit et les lieux de sa fabrication. Il incombe aussi au Ministère de surveiller les produits et les établissements de fabrication après la mise sur le marché du produit. Toutefois, c’est l’industrie elle-même qui est principalement responsable de l’innocuité et de l’efficacité des produits et des établissements de fabrication.
2.7 Santé Canada peut faire respecter les conditions d’homologation des produits de santé naturels et de leurs lieux de fabrication en prenant les mesures suivantes, par exemple :
- décréter la suspension ou l’annulation de l’homologation;
- ordonner de cesser de vendre les produits;
- saisir les produits;
- demander des rappels volontaires de produits;
- publier des mises en garde à la population et des avis sanitaires sur le site Web de Santé Canada.
2.8 Santé Canada n’est toutefois pas habilité à ordonner le changement d’une étiquette ni le rappel obligatoire d’un produit de santé naturel pour quelque raison que ce soit, et ce, même si le produit présente un risque grave ou imminent de préjudice à la santé.
Objet de l’audit
2.9 Cet audit visait à déterminer si Santé Canada avait pris les mesures nécessaires pour garantir l’innocuité des produits de santé naturels vendus au Canada et la présentation aux consommateurs de renseignements exacts sur ces produits.
2.10 Cet audit est important parce que beaucoup de Canadiennes et de Canadiens consomment des produits de santé naturels. Ils s’attendent à ce que ces produits soient sûrs et efficaces, et ils s’attendent à recevoir des renseignements exacts à leur sujet.
2.11 La section intitulée À propos de l’audit, à la fin du présent rapport, donne des précisions sur l’objectif, l’étendue, la méthode et les critères de l’audit.
Constatations, recommandations et réponses
Message général
2.12 Dans l’ensemble, la surveillance exercée par Santé Canada sur les produits de santé naturels commercialisés au Canada n’a pas permis de garantir l’innocuité et l’efficacité de ces produits. Le Ministère a approuvé des produits en se fondant sur des preuves démontrant qu’ils étaient sûrs et efficaces. Toutefois, des lacunes dans la surveillance des lieux de fabrication et dans le suivi des produits une fois sur le marché ont exposé les consommateurs à des risques potentiels pour la santé et la sécurité du fait que les produits n’étaient pas toujours fabriqués ou commercialisés selon les conditions d’homologation.
2.13 Vu l’absence d’inspections régulières, Santé Canada n’a pas pu s’assurer que les établissements de fabrication suivaient les bonnes pratiques de fabrication. Le Ministère n’a pas non plus surveillé l’information qui figure sur les étiquettes des produits pour vérifier si ces produits correspondaient bien à la description sur l’étiquette ou s’ils avaient été homologués pour la vente. Si les conditions d’homologation ne sont pas respectées, les produits pourraient ne pas apporter les bienfaits promis pour la santé ou ils pourraient entraîner des effets indésirables pouvant aller de légers à graves. Santé Canada a fait enquête sur les produits soupçonnés de poser des risques graves pour la santé, comme des effets indésirables, et est intervenu immédiatement pour éliminer ces risques. Cette approche adoptée par le Ministère était réactive et n’a pas toujours abouti au retrait du marché de tous les produits en cause.
2.14 Durant la pandémie de maladie à coronavirus (COVID‑19)Définition 1, le Ministère a modifié son approche pour l’homologation de désinfectants pour les mains. Cela a aidé à remédier à la pénurie sur le marché de produits d’assainissement nécessaires pour freiner la propagation du coronavirus. Santé Canada a aussi surveillé de façon proactive les publicités pour les produits de santé naturels assortis d’allégations santé en lien avec la COVID‑19. Le Ministère a pris les mesures qui s’imposaient lorsqu’il a relevé des allégations fausses. Toutefois, nous avons constaté qu’au moment de l’audit, des allégations non autorisées circulaient encore pour bon nombre de produits de santé naturels homologués et non homologués.
L’innocuité et l’efficacité des produits de santé naturels
2.15 Les produits de santé naturels constituent un sous-ensemble de médicaments aux termes de la Loi sur les aliments et drogues. Ils sont régis par le Règlement sur les produits de santé naturels, qui s’applique à la fabrication, à l’emballage, à l’étiquetage, à l’importation, à la distribution, à l’entreposage et à la vente de ces produits. Chaque produit de santé naturel vendu ou importé au Canada doit être assorti d’une licence de mise en marché de Santé Canada et être fabriqué dans un établissement titulaire d’une licence d’exploitation délivrée par le Ministère.
2.16 La pièce 2.2 résume les processus suivis par Santé Canada pour délivrer une licence de mise en marché d’un produit de santé naturel ainsi qu’une licence d’exploitation pour la fabrication d’un tel produit.
Pièce 2.2 — Processus de délivrance d’une licence de mise en marché d’un produit de santé naturel et d’une licence d’exploitation pour la fabrication d’un tel produit
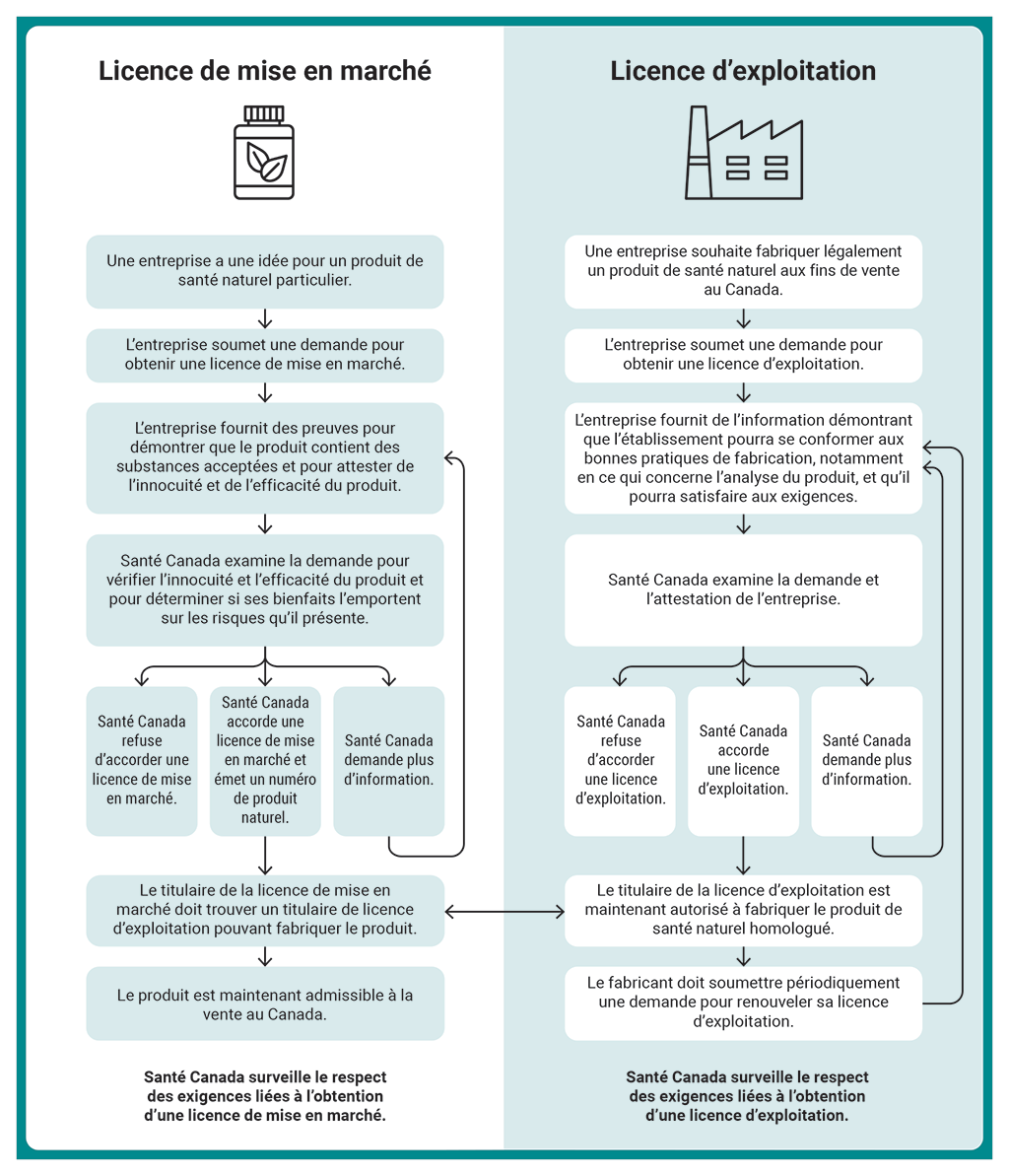
Pièce 2.2 — version textuelle
Cet organigramme présente les processus appliqués par Santé Canada pour délivrer une licence de mise en marché d’un produit de santé naturel et une licence d’exploitation pour la fabrication d’un tel produit.
Voici une description détaillée du processus de délivrance d’une licence de mise en marché d’un produit de santé naturel :
- Une entreprise a une idée pour un produit de santé naturel particulier. Elle soumet une demande pour obtenir une licence de mise en marché. L’entreprise fournit des preuves pour démontrer que le produit contient des substances acceptées et pour attester de l’innocuité et de l’efficacité du produit.
- Santé Canada examine ensuite la demande pour vérifier l’innocuité et l’efficacité du produit et pour déterminer si ses bienfaits l’emportent sur les risques qu’il présente. Cet examen peut aboutir à l’un des trois résultats suivants : Santé Canada refuse d’accorder une licence de mise en marché, ce qui met fin au processus; ou bien Santé Canada accorde une licence de mise en marché et émet un numéro de produit naturel; ou encore Santé Canada demande plus d’information.
- Si Santé Canada demande plus d’information, l’entreprise doit fournir l’information demandée. Après avoir reçu cette information, Santé Canada peut finir l’examen de la demande de licence.
- Si Santé Canada accorde une licence de mise en marché et émet un numéro de produit naturel, le titulaire de la licence doit trouver un titulaire de licence d’exploitation pouvant fabriquer le produit. Celui-ci est maintenant admissible à la vente au Canada.
- La dernière étape du processus est que Santé Canada surveille le respect des exigences liées à l’obtention d’une licence de mise en marché.
Voici une description détaillée du processus de délivrance d’une licence d’exploitation pour la fabrication d’un produit naturel :
- Une entreprise souhaite fabriquer légalement un produit de santé naturel aux fins de vente au Canada. Elle soumet une demande pour obtenir une licence d’exploitation. L’entreprise fournit de l’information démontrant que l’établissement pourra se conformer aux bonnes pratiques de fabrication, notamment en ce qui concerne l’analyse du produit, et qu’il pourra satisfaire aux exigences.
- Santé Canada examine ensuite la demande et l’attestation de l’entreprise. Cet examen peut aboutir à l’un des trois résultats suivants : Santé Canada refuse d’accorder une licence d’exploitation, ce qui met fin au processus; ou bien Santé Canada accorde une licence d’exploitation au fabricant; ou encore Santé Canada demande plus d’information.
- Si Santé Canada demande plus d’information, l’entreprise doit fournir l’information demandée. Après avoir reçu cette information, Santé Canada peut finir son examen de la demande de licence.
- Si Santé Canada accorde une licence d’exploitation au fabricant, celui-ci est maintenant autorisé à fabriquer le produit de santé naturel homologué. Le fabricant doit soumettre périodiquement une demande pour renouveler sa licence d’exploitation. Cela oblige l’entreprise à fournir de l’information démontrant que l’établissement peut se conformer aux bonnes pratiques de fabrication, notamment en ce qui concerne l’analyse du produit, et qu’il pourra satisfaire aux exigences applicables.
- La dernière étape du processus est que Santé Canada surveille le respect des exigences liées à l’obtention d’une licence d’exploitation.
Santé Canada n’a pas vérifié si les établissements suivaient les bonnes pratiques de fabrication avant la mise en marché des produits
2.17 Nous avons constaté que Santé Canada ne vérifiait pas toujours si les établissements chargés de la fabrication suivaient les bonnes pratiques de fabrication avant que les produits de santé naturels soient commercialisés au Canada. Le Ministère s’appuyait sur les attestations des fabricants indiquant que leurs établissements respectaient les bonnes pratiques de fabrication.
2.18 L’analyse à l’appui de cette constatation porte sur :
2.19 Cette constatation est importante parce qu’il incombe à Santé Canada de vérifier si les produits de santé naturels ont été fabriqués dans des établissements où les bonnes pratiques de fabrication sont suivies. Ces pratiques permettent de veiller à ce que les produits soient sûrs et efficaces tels que décrits.
2.20 Notre recommandation relativement au secteur examiné est présentée au paragraphe 2.26.
Le recours aux attestations des fabricants
2.21 Santé Canada exige des demandeurs de licence d’exploitation qu’ils attestent, au moyen d’une déclaration écrite, de l’application des bonnes pratiques de fabrication. Nous avons constaté que le Ministère se fiait aux attestations des fabricants de produits de santé naturels selon lesquelles leurs établissements appliquaient les bonnes pratiques de fabrication, et que le Ministère ne réalisait pas d’inspection avant la mise en marché des produits. Nous avons noté que le Ministère adoptait une approche différente à l’égard des fabricants de médicaments : il réalise une inspection initiale avant la mise en marché de ces produits. Les bonnes pratiques de fabrication sont des contrôles clés pour garantir que les produits de santé naturels :
- contiennent les bons ingrédients médicinaux au bon dosage;
- sont exempts de toute contamination microbienne et chimique;
- restent actifs et stables jusqu’à leur date d’expiration;
- sont fabriqués par du personnel qualifié à l’aide d’équipement dans des établissements qui suivent de bonnes pratiques d’hygiène.
2.22 Nous avons examiné un échantillon de 25 licences d’exploitation actives (sur 250) délivrées par Santé Canada entre 2017 et 2019 à des établissements de fabrication canadiens et à des établissements d’importateurs canadiens à l’étranger, ainsi que leur première demande de renouvellement de licence. Nous avons examiné si Santé Canada avait vérifié, avant la mise en marché des produits, que les établissements suivaient les bonnes pratiques de fabrication.
2.23 Pour 13 des 25 établissements compris dans notre échantillon, Santé Canada s’était fié à des inspections, comme des inspections de médicaments, réalisées par des autorités nationales et des autorités de réglementation d’autres pays pour délivrer la licence à ces établissements. Toutefois, nous avons constaté que le Ministère n’avait pas l’assurance que 10 de ces 13 établissements suivaient les bonnes pratiques de fabrication parce que le Ministère n’avait pas de preuves attestant que ces inspections visaient aussi les gammes de produits de santé naturels.
2.24 Pour les 12 autres établissements de notre échantillon, Santé Canada a obtenu certains renseignements sur l’établissement avant de délivrer la licence. Toutefois, le Ministère n’a pas vérifié un ou plusieurs des types de preuves importants énumérés ci-dessous qui permettent de démontrer que les établissements suivaient les bonnes pratiques de fabrication :
- les preuves que la personne responsable de l’assurance qualité de l’établissement avait les qualifications nécessaires;
- le caractère adéquat des procédures opérationnelles normalisées visant l’analyse des produits, le programme d’hygiène, l’assurance qualité, les lieux et l’équipement;
- les résultats de l’analyse des produits qui démontrent que les spécifications du produit ont été respectées.
2.25 Santé Canada ne peut pas vérifier certaines bonnes pratiques de fabrication, notamment les méthodes d’analyse des produits, tant que la production n’a pas commencé. En outre, le Ministère n’est pas informé de la date de mise en marché des produits de santé naturels, contrairement aux médicaments, pour lesquels il est avisé lorsque les produits sont mis en vente. Par conséquent, Santé Canada ne pouvait pas vérifier si les produits de santé naturels vendus aux consommateurs canadiens étaient fabriqués dans des établissements qui suivaient les bonnes pratiques de fabrication avant la mise en marché des produits.
2.26 Recommandation — Santé Canada devrait obtenir :
- des preuves suffisantes pour vérifier que les titulaires d’une licence d’exploitation suivent les bonnes pratiques de fabrication avant que les produits soient mis sur le marché;
- de l’information indiquant quels produits de santé naturels sont offerts sur le marché.
Réponse du Ministère — Recommandation acceptée. Santé Canada reconnaît que ses autorités réglementaires sont limitées et ne permettent pas d’obliger les entreprises à fournir des informations sur la qualité dans le cadre du processus de demande de licence de produit. Les demandeurs sont seulement tenus d’attester que leur produit rencontrera les exigences en termes de qualité. Afin d’améliorer la surveillance de la qualité avant la mise en marché des produits de santé naturels, le Ministère a utilisé des renseignements recueillis dans le cadre de deux projets de surveillance de la conformité et d’un audit sous forme papier des bonnes pratiques de fabrication chez un certain nombre de fabricants. Le Ministère reconnaît également que les produits de santé naturels sont la seule gamme de produits de santé pour laquelle toutes les activités de réglementation sont financées par le public. L’absence d’un cadre de financement stable et les pouvoirs réglementaires limités concernant la qualité ont exercé une pression considérable sur le Ministère pour qu’il exécute ses activités réglementaires et réponde efficacement au nombre et à la complexité scientifique de plus en plus élevés des demandes de licence de produits. Santé Canada va :
- établir des options entièrement chiffrées pour une approche de la surveillance de la qualité fondée sur les risques avant la délivrance ou le renouvellement des licences et déterminer l’ensemble des implications réglementaires et opérationnelles de ces options;
- explorer les mécanismes permettant d’obtenir des informations sur les produits disponibles sur le marché;
- prendre des mesures afin de proposer le recouvrement des coûts pour les produits de santé naturels afin de compenser les frais associés à la délivrance des licences et aux activités post-commercialisation.
Santé Canada a laissé des produits de santé naturels sans surveillance après leur mise en marché et n’a pas toujours réussi à régler les problèmes graves
2.27 Nous avons constaté que Santé Canada avait peu fait pour empêcher que des renseignements de piètre qualité sur les produits de santé naturels homologués soient communiqués aux consommateurs. Le Ministère a exercé une surveillance limitée à l’égard des produits homologués et des fabricants titulaires d’une licence d’exploitation ainsi qu’à l’égard des produits non homologués, notamment pour vérifier si les renseignements présentés sur les étiquettes des produits et dans les publicités concernant ces produits étaient trompeurs. La surveillance que le Ministère exerçait à l’égard des produits consistait plutôt à réagir aux plaintes portées à son attention. Lorsqu’il intervenait après avoir trouvé des problèmes liés à des produits de santé naturels, le Ministère ne réussissait pas toujours à régler ces problèmes.
2.28 L’analyse à l’appui de cette constatation porte sur :
- la piètre qualité des renseignements communiqués aux consommateurs sur les produits homologués;
- la surveillance limitée à l’égard des produits homologués et des fabricants titulaires d’une licence;
- la surveillance limitée à l’égard des produits non homologués et des activités non autorisées;
- un succès mitigé dans le règlement de problèmes graves liés à des produits.
2.29 Cette constatation est importante parce que les produits ne devraient pas être mis sur le marché à moins qu’ils soient sûrs et que l’information communiquée aux consommateurs soit exacte et exhaustive.
2.30 Nos recommandations relativement au secteur examiné sont présentées aux paragraphes 2.35, 2.47, 2.51 et 2.56.
La piètre qualité des renseignements communiqués aux consommateurs sur les produits homologués
2.31 Nous avons examiné si, avant d’approuver les produits de santé naturels, Santé Canada s’assurait d’avoir les preuves appropriées pour attester de l’innocuité et de l’efficacité de ces produits. Nous avons constaté que le Ministère approuvait les produits de santé naturels en se fondant sur des preuves d’innocuité appropriées. Le Règlement sur les produits de santé naturels exige que des renseignements indiquant l’innocuité et l’efficacité du produit figurent sur l’étiquette du produit pour aider les consommateurs à faire des choix éclairés. L’information sur l’innocuité et l’efficacité qui doit être communiquée aux consommateurs fait partie des conditions d’homologation du produit.
2.32 Nous avons constaté que Santé Canada n’exerçait pas une surveillance suffisante pour déterminer si les renseignements présentés sur l’étiquette du produit et dans les publicités concernant ce produit répondaient aux conditions d’homologation du produit. Nous avons constaté que le Ministère surveillait les étiquettes et les publicités pour donner suite à des plaintes, au lieu de surveiller le marché selon une approche fondée sur le risque. Pour acquérir une compréhension du marché, nous avons examiné un échantillon de 75 produits homologués aux fins de vente sur des sites Web canadiens. Nous avons constaté que pour 88 % de ces produits, les publicités présentaient des renseignements trompeurs. De plus, 56 % des produits que nous avons examinés avaient été mis sur le marché avec une étiquette présentant des renseignements trompeurs, c’est-à-dire qui comportait l’un ou plusieurs des problèmes suivants :
- des allégations santé non autorisées par Santé Canada parce qu’elles pourraient ne pas avoir été prouvées, notamment des allégations selon lesquelles le produit aiderait à soulager la fatigue, à accroître l’endurance ou à brûler les graisses;
- un énoncé erroné selon lequel le produit était recommandé pour les enfants de 3 ans et plus, alors que le produit avait en fait été autorisé uniquement pour les adolescents et les adultes;
- une liste incomplète des risques et des ingrédients autorisés;
- le mauvais dosage des ingrédients médicinaux;
- des renseignements présentés sur l’étiquette, comme des mises en garde, imprimés en très petits caractères (soit dans une police de taille 4); les caractères imprimés sur papier dans des polices dont la taille est inférieure à 8 sont difficiles à lire sans loupe; selon Santé Canada, la mauvaise lisibilité des renseignements sur l’étiquette imprimée contribue à une mauvaise utilisation du produit.
Au cours de notre audit, Santé Canada a entrepris des activités de suivi de certaines des publicités et des étiquettes qui présentaient des renseignements trompeurs, en réponse à nos constatations.
2.33 Nous avons aussi constaté que plus du quart des 75 produits homologués que nous avons examinés n’indiquaient pas s’ils avaient un numéro de produit naturel attribué par Santé Canada. Cette constatation est importante parce que le Ministère recommande aux consommateurs d’acheter uniquement les produits dont le numéro de produit naturel figure sur l’étiquette, car cela signifie que le Ministère a évalué l’innocuité et l’efficacité de ces produits. Bien que le Règlement exige que le numéro de produit naturel figure sur l’étiquette ou l’emballage du produit, il ne l’exige pas pour l’information affichée en ligne.
2.34 Les consommateurs peuvent obtenir de l’information sur les produits de santé naturels dans la Base de données sur les produits de santé naturels homologués de Santé Canada. Nous avons constaté que cette base de données en ligne contenait tous les renseignements sur l’innocuité du produit pour les licences de mise en marché que nous avons examinées, sauf la source des ingrédients médicinaux et la durée d’utilisation recommandée. Ces renseignements sur l’innocuité du produit sont importants pour faire en sorte que les consommateurs se servent des produits selon leur utilisation recommandée.
2.35 Recommandation — Santé Canada devrait adopter une approche fondée sur le risque pour les produits de santé naturels homologués mis en vente sur le marché, y compris sur Internet, afin de :
- veiller à ce que les étiquettes des produits soient lisibles;
- surveiller l’information figurant sur les étiquettes et dans les publicités des produits pour s’assurer qu’elle contient des renseignements exacts et exhaustifs sur les produits, conformément aux conditions de leur homologation.
Réponse du Ministère — Recommandation acceptée. Santé Canada a commencé à prendre des mesures, par un engagement extensif des parties prenantes et le développement d’un projet de réglementation, pour améliorer l’étiquetage des produits de santé naturels, pour les rendre plus faciles à lire, à comprendre et à comparer avec d’autres produits similaires. Le Ministère va :
- poursuivre les changements réglementaires et politiques pour améliorer l’étiquetage des produits de santé naturels;
- étudier les possibilités d’obliger les détenteurs de licences à afficher une étiquette canadienne, y compris un numéro de produit naturel, dans les publicités destinées aux Canadiens;
- poursuivre la mise en œuvre d’une stratégie globale de surveillance proactive pour s’assurer que la publicité des produits de santé naturels est conforme à la licence du produit.
La surveillance limitée à l’égard des produits homologués et des fabricants titulaires d’une licence d’exploitation
2.36 Nous avons constaté que Santé Canada n’avait pas de programme prévoyant, selon un cycle préétabli, des inspections régulières sur place des établissements de fabrication des produits de santé naturels. Or, nous avons noté que d’autres organismes de réglementation en santé, par exemple en Australie et en Europe, avaient établi un cycle pour la réalisation d’inspections régulières des établissements de fabrication sur une période de quatre ans.
2.37 Nous avons constaté que Santé Canada avait recensé des établissements jugés à risque élevé, mais uniquement des lieux de fabrication de produits stériles, comme les produits de soins pour les yeux. Le Ministère n’avait pas recensé les établissements titulaires de licences d’exploitation qui fabriquaient d’autres types de produits de santé naturels à risque élevé, notamment :
- les produits destinés à des populations vulnérables, comme les enfants et les femmes enceintes ou qui allaitent;
- les produits assortis d’allégations visant des problèmes de santé particuliers, comme le diabète;
- les produits pour lesquels il existe des antécédents de substitution d’ingrédients, comme ceux destinés à la perte de poids et à l’amélioration de la performance sexuelle.
2.38 Nous avons constaté que Santé Canada avait eu de la difficulté à surveiller les produits homologués, notamment en raison du grand nombre de ces produits. Depuis 2004, le Ministère a homologué 91 000 produits de santé naturels. Or, selon ses propres estimations, seulement la moitié de ces produits ont été mis sur le marché au Canada. En outre, il y avait dix fois plus de demandes d’homologation de produits de santé naturels que de demandes d’homologation de médicaments en vente libre. De plus, de nombreuses demandes étaient redondantes. Voici certains facteurs ayant contribué à ce grand nombre de demandes d’homologation de produits de santé naturels :
- Les entreprises pouvaient soumettre de multiples demandes pour des produits hypothétiques qui n’avaient pas encore été développés.
- Les demandeurs n’étaient pas tenus de payer des frais pour soumettre une demande de licence de mise en marché ou de licence d’exploitation, contrairement à ce qui est exigé pour tous les autres produits de santé réglementés par Santé Canada.
2.39 Nous avons constaté que Santé Canada ne savait pas où tous les produits homologués étaient fabriqués. Les titulaires de licence de mise en marché de produits de santé naturels sont tenus de signaler au Ministère dans quels établissements titulaires d’une licence d’exploitation leurs produits sont fabriqués avant de les vendre. Toutefois, moins de 5 % des titulaires d’une licence de mise en marché active le faisaient. Le Ministère ne veillait pas au respect de cette exigence et ne communiquait pas avec les titulaires d’une licence de mise en marché pour obtenir cette information. En outre, le Ministère n’était pas tenu d’être informé de l’arrivée des produits homologués sur le marché canadien ni du retrait de ces produits du marché. Il était donc difficile pour le Ministère de recenser les établissements de fabrication à risque élevé de manière à affecter en conséquence ses ressources consacrées à la surveillance.
2.40 Nous avons constaté que Santé Canada exerçait une surveillance limitée des fabricants titulaires d’une licence d’exploitation. En 2016, le Ministère a réalisé des inspections sur place, dans le cadre d’un projet pilote, pour vérifier si les établissements appliquaient les bonnes pratiques de fabrication. Entre 2017 et 2019, il a inspecté environ 6 % des 766 établissements titulaires d’une licence active. Le Ministère a choisi des établissements au pays de façon aléatoire ou en raison de leurs mauvais antécédents en matière de conformité. Il a aussi choisi tous les établissements qui fabriquaient des produits stériles parce que ceux-ci étaient considérés comme les produits présentant le risque le plus élevé. Même si Santé Canada disposait d’information sur les processus de fabrication utilisés dans ces établissements, le Ministère n’avait pas d’information sur les produits qui étaient fabriqués dans tous les établissements. Par conséquent, il ne pouvait pas recenser et inspecter tous les établissements à risque élevé.
2.41 Dans le cadre de ses inspections, Santé Canada a constaté un niveau élevé de non-conformité au sein de l’industrie relativement à la fabrication des produits et à leur qualité. Les inspections sur place ont permis de relever des problèmes de qualité des produits dans tous les établissements. Dans près de la moitié des 46 établissements inspectés entre 2017 et 2019, Santé Canada a dû prendre des mesures réglementaires parce que d’importants risques pour la santé avaient été détectés. Le Ministère a notamment dû révoquer 7 licences d’exploitation et suspendre ou annuler 5 licences de mise en marché.
2.42 Nous avons examiné les dossiers de 7 des 46 inspections réalisées pour déterminer si Santé Canada avait vérifié que les entreprises avaient corrigé les problèmes relevés avant de renouveler leur licence d’exploitation. Dans 2 cas, le Ministère a déterminé que les entreprises n’avaient pas de plan d’action acceptable et a refusé de renouveler leur licence d’exploitation. Toutefois, nous avons constaté qu’une de ces entreprises vendait encore sans licence ses produits en ligne en octobre 2020.
2.43 Nous avons constaté que dans les 5 autres dossiers d’inspection, Santé Canada avait vérifié les renseignements corroborant la date d’expiration du produit et les résultats des analyses de certains produits. Toutefois, nous avons constaté que le Ministère avait renouvelé ces 5 licences d’exploitation sans vérifier si les entreprises suivaient les autres bonnes pratiques de fabrication, notamment celle de confirmer si les produits sont exempts de contaminants chimiques.
2.44 Nous avons aussi examiné un échantillon de 25 demandes de renouvellement initial de licences d’exploitation qui avaient été approuvées par Santé Canada après la commercialisation des produits. Nous avons constaté que pour 22 demandes sur 25, le Ministère n’avait pas vérifié si tous les établissements suivaient les bonnes pratiques de fabrication. S’il ne s’assure pas de vérifier systématiquement que les résultats des analyses du produit correspondent aux spécifications ou que les procédures clés documentées sont conformes aux bonnes pratiques de fabrication, le Ministère ne peut pas garantir l’innocuité et l’efficacité des produits. Nous avons constaté que, même après le premier renouvellement de leur licence d’exploitation, la plupart des établissements ne démontraient toujours pas qu’ils appliquaient pleinement les bonnes pratiques de fabrication. Nous avons notamment constaté ce qui suit :
- 9 entreprises comptaient une ou plusieurs procédures opérationnelles normalisées incomplètes en ce qui concerne l’analyse des produits, le programme d’hygiène, l’assurance qualité, les lieux ou l’équipement.
- 17 entreprises n’ont pas fourni les résultats de l’analyse des produits qui confirmaient la nature et la quantité des ingrédients médicinaux, la date d’expiration du produit et l’absence de contaminants chimiques et microbiens.
- 7 entreprises n’ont pas fourni de preuves que leur responsable de l’assurance qualité avait les qualifications nécessaires.
2.45 Santé Canada a réalisé d’autres activités pour recueillir de l’information sur la conformité, qui ont aussi fait ressortir des problèmes de qualité chez certains fabricants. Par exemple, en 2019, le Ministère a mené un examen auprès de 35 entreprises pour évaluer les résultats de l’analyse de 2 produits que chacune de ces entreprises avait récemment commercialisés. Le Ministère a relevé des problèmes dans tous les établissements, notamment le recours à des matières premières périmées, la présence de quantités inacceptables de contaminants et des analyses qui ne confirmaient pas la date d’expiration du produit. Santé Canada a pris des mesures réglementaires à l’égard de la moitié des 35 entreprises; le Ministère a notamment publié un avis d’intention de suspension d’une licence d’exploitation en raison de la gravité des problèmes relevés.
2.46 À notre avis, les constatations de Santé Canada montrent que le fait de se fier aux attestations des fabricants sur l’application des bonnes pratiques de fabrication pour approuver les licences d’exploitation comporte des risques. Certaines des situations relevées par Santé Canada auraient pu être évitées si le Ministère avait fait une vérification plus approfondie relativement aux bonnes pratiques de fabrication avant de délivrer et de renouveler les licences d’exploitation.
2.47 Recommandation — Santé Canada devrait élaborer un programme de surveillance et d’inspection fondé sur le risque qui établit l’étendue et la fréquence des inspections et qui tient compte des risques liés aux produits, aux établissements et aux problèmes cernés dans le cadre de ses activités de suivi.
Réponse du Ministère — Recommandation acceptée. Santé Canada reconnaît que les produits de santé naturels sont la seule gamme de produits de santé pour laquelle il n’est pas possible d’exiger un rappel ou d’imposer des modalités pour atténuer les risques de sécurité associés à ces produits. Le Ministère a complété un certain nombre de projets de surveillance de la conformité pour recueillir de l’information concernant la surveillance de la qualité des produits de santé naturels, et reconnaît la nécessité d’étendre ses activités à un programme d’inspection plus solide. Santé Canada va :
- aller de l’avant avec un programme pilote d’inspection des bonnes pratiques de fabrication des produits de santé naturels afin de promouvoir et de vérifier la conformité de l’industrie des produits de santé naturels par le biais d’inspections des titulaires de licence dans tout le Canada, et prendre d’autres mesures en fonction des résultats de ce projet pilote;
- prendre des mesures afin de proposer de nouveaux outils pour renforcer la capacité du Ministère à dissuader et à traiter les cas de non-conformité, ce qui comprend aller de l’avant pour proposer d’étendre les pouvoirs de la Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa) aux produits de santé naturels;
- entreprendre une analyse afin d’établir des options entièrement chiffrées pour une approche aux inspections fondée sur les risques;
- prendre des mesures afin de proposer l’extension du recouvrement des coûts aux produits de santé naturels pour compenser les frais associés aux activités post-commercialisation.
La surveillance limitée à l’égard des produits non homologués et des activités non autorisées
2.48 Nous avons constaté que Santé Canada avait surveillé les mises en garde diffusées par des organismes de réglementation internationaux. Nous avons aussi constaté que le Ministère avait fait enquête lorsqu’il avait appris l’existence de problèmes graves causés par un produit non conforme, c’est-à-dire soit un produit non homologuéDéfinition 2, soit un produit homologué associé à une activité non autoriséeDéfinition 3. Nous avons constaté que Santé Canada ne disposait pas d’un programme pour surveiller activement les produits non homologués à risque élevé qui sont offerts sur le marché. En dépit du nombre croissant de ces produits mis en vente au Canada, surtout en ligne, le Ministère a peu fait pour surveiller les produits non conformes.
2.49 Nous avons vérifié si Santé Canada avait surveillé les produits à risque élevé signalés par des organisations canadiennes et étrangères qui se spécialisent dans les analyses des produits de santé naturels et l’examen de leurs étiquettes. Les produits signalés étaient soupçonnés de contenir des substituts ou d’autres substances toxiques comme des stimulants, pouvant poser des risques graves pour la santé. Nous avons constaté que Santé Canada n’avait pas effectué de suivi en vue de déterminer si des produits contenant les mêmes substances étaient vendus au Canada. Lors de notre examen de 61 produits soupçonnés de poser un risque élevé, nous avons constaté que 38 d’entre eux pouvaient être achetés en ligne au Canada, et ce, même s’ils n’avaient pas fait l’objet d’une licence de mise en marché (homologation) de Santé Canada.
2.50 Aux termes de la Loi sur les aliments et drogues, il est interdit d’alléguer qu’un produit guérit ou soigne le cancer. Le Règlement sur les produits de santé naturels autorise quant à lui certaines allégations selon lesquelles un produit pourrait prévenir le cancer, sous réserve du respect des conditions d’homologation du produit. Nous avons examiné les publicités concernant 48 produits vendus en ligne qui comportaient des allégations sur le cancer. Nous avons constaté qu’aucune de ces allégations n’avait été autorisée par Santé Canada et que 4 de ces produits n’avaient pas été homologués.
2.51 Recommandation — Santé Canada devrait élaborer un programme de surveillance fondé sur les risques qui lui permettrait :
- de détecter les produits non homologués et de prendre des mesures appropriées pour empêcher qu’ils soient vendus au Canada;
- de détecter les activités non autorisées et de prendre des mesures appropriées pour que les étiquettes et les publicités sur les produits soient conformes aux conditions d’homologation des produits.
Réponse du Ministère — Recommandation acceptée. Santé Canada maintient actuellement un programme basé sur les plaintes pour la surveillance de la conformité réglementaire de la publicité et reconnaît qu’une approche supplémentaire basée sur le risque est nécessaire pour garantir que les activités non autorisées sont prévenues et/ou arrêtées. Le Ministère va :
- poursuivre la mise en œuvre d’une approche fondée sur le risque pour la surveillance de la publicité;
- prendre des mesures afin de proposer de nouveaux outils pour renforcer sa capacité à dissuader et à traiter les cas de non-conformité, ce qui comprend aller de l’avant pour proposer d’étendre les pouvoirs de la Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa) aux produits de santé naturels.
Un succès mitigé dans le règlement de problèmes graves liés à des produits
2.52 Les titulaires d’une licence de mise en marché de produits de santé naturels sont tenus de signaler à Santé Canada tout effet indésirable grave causé par leurs produits, aux termes du Règlement sur les produits de santé naturels. D’autres groupes, comme les hôpitaux et le public, peuvent porter plainte s’ils soupçonnent qu’un produit, homologué ou non, a causé un effet indésirable, notamment un effet grave sur la santé ou un handicap. À la suite d’un signalement, le Ministère ouvrira une enquête sur les produits soupçonnés de poser des risques graves pour la santé. Entre 2017 et 2019, le Ministère a ouvert 40 dossiers d’enquête qui portaient chacun sur un ou plusieurs produits.
2.53 Dans la plupart des cas que nous avons examinés, lorsque Santé Canada avait relevé des problèmes graves, comme un problème de qualité associé à un produit ou à un établissement ou encore des effets indésirables ayant abouti à une hospitalisation, nous avons constaté que le Ministère avait pris immédiatement des mesures pour contrer les risques de santé graves. Le Ministère a par exemple communiqué des renseignements au public et, au besoin, pris des mesures d’application de la loi. Il a notamment interdit la vente des produits et demandé un rappel volontaire des produits. Le Ministère a réussi à retirer les produits du marché au terme de 36 de ses 40 enquêtes sur des produits posant des risques graves pour la santé. Toutefois, il a fallu en moyenne près de 3 mois au Ministère pour vérifier que les produits en question avaient été retirés du marché. Dans le cas des rappels volontaires de produits, le Ministère a mis environ 6 mois pour vérifier que les rappels avaient été pleinement effectués.
2.54 Pour les 4 autres enquêtes visant des produits posant des risques de santé graves, les mesures prises par le Ministère n’ont pas permis de mettre fin à la vente des produits pour l’une ou l’autre des raisons suivantes :
- L’entreprise n’a pas respecté l’avis de saisie du Ministère. (La pièce 2.3 explique en détail les mesures prises par le Ministère dans ce cas.)
- Le Ministère n’avait pas reçu suffisamment de renseignements pour prouver que les produits faisant l’objet d’un rappel avaient été récupérés, détruits ou retirés du marché.
- Le Ministère n’avait pas reçu suffisamment de renseignements pour prouver que l’entreprise avait cessé de vendre ou d’importer les produits et s’était débarrassée de tous les produits en sa possession.
- Le domaine Internet hébergeant la publicité sur le produit n’a pas donné suite à la demande du Ministère de retirer la publicité sur le produit non homologué.
Pièce 2.3 — Santé Canada n’a pas réussi à faire retirer du marché un produit de santé naturel qui contenait des ingrédients pharmaceutiques
Voici la chronologie des mesures prises par Santé Canada à l’égard d’un problème de santé signalé dans un cas portant sur trois produits connexes vendus par un importateur.
| Date | Mesures prises par Santé Canada ou l’importateur |
|---|---|
| Avril 2017 | Rapport sur des effets indésirables — Santé Canada reçoit un rapport sur des effets indésirables qui ont notamment conduit à l’hospitalisation d’une personne ayant consommé au moins un des trois produits en cause. Le rapport contient les résultats d’une analyse faite par un centre antipoison indiquant que les produits contiennent des ingrédients pharmaceutiques pouvant causer des fausses couches. |
| Mai 2017 | Saisie des produits — Le Ministère fait saisir les trois produits à l’établissement canadien où ils sont stockés. |
| Août 2017 | Analyse des produits — Après une analyse approfondie des produits, le Ministère constate qu’un des trois produits (le « produit A ») contient des ingrédients pharmaceutiques pouvant causer des fausses couches et des malformations congénitales. |
| Octobre 2017 | Demande de rappel volontaire — Le Ministère demande à l’importateur d’effectuer un rappel du produit A. |
| Novembre 2017 | Avis de signalement à la frontière et avis à la population — Le Ministère diffuse un avis de signalement à la frontière pour empêcher l’importation du produit A. Il diffuse aussi un avis à la population. |
| Décembre 2017 | Visite sur place non annoncée — Le Ministère effectue une visite non annoncée à l’établissement. Il constate qu’une certaine quantité de produits visés par l’ordre de saisie avait été retirée de l’établissement. Le Ministère suspend immédiatement l’homologation (licence de mise en marché) des trois produits. |
| Janvier 2018 | Reconnaissance par l’importateur de la possibilité d’une contamination des produits — L’importateur admet qu’il est possible que les produits en cause aient été contaminés par des ingrédients pharmaceutiques pouvant causer des fausses couches et des malformations congénitales. |
| Juin 2018 | Annulation et fin de la suspension de l’homologation — Santé Canada annule la licence de mise en marché du produit A et lève la suspension de la licence des deux autres produits. |
| Octobre 2020 | Poursuite de la commercialisation du produit en ligne — Le produit A est toujours en vente sur le site Web canadien de l’entreprise même s’il n’est plus homologué. |
2.55 En octobre 2020, nous avons constaté que, dans 2 des 4 cas concernant des produits posant des risques graves pour la santé, les produits étaient toujours vendus en ligne par le même détaillant. De plus, parmi les produits retirés du marché par Santé Canada au terme de 36 enquêtes menées avec succès entre 2017 et 2019, 7 produits avaient été remis sur le marché.
2.56 Recommandation — Lorsque des produits sont soupçonnés de poser des risques graves pour la santé, Santé Canada devrait obtenir les renseignements dont il a besoin pour vérifier et garantir que ces produits ne sont plus en vente au Canada.
Réponse du Ministère — Recommandation acceptée. En plus des mesures immédiates que Santé Canada prend déjà pour protéger la santé et la sécurité des Canadiens lorsqu’un risque grave pour la santé est identifié, Santé Canada va :
- prendre des mesures afin de proposer de nouveaux outils pour renforcer sa capacité à dissuader et à traiter les cas de non-respect, ce qui comprend aller de l’avant pour proposer d’étendre les pouvoirs de la Loi visant à protéger les Canadiens contre les drogues dangereuses (Loi de Vanessa) aux produits de santé naturels;
- prendre des mesures afin de proposer l’extension du recouvrement des coûts aux produits de santé naturels pour compenser les frais associés à la délivrance des licences et aux activités post-commercialisation.
Santé Canada a pris des mesures efficaces à l’égard des produits de santé naturels liés à la COVID‑19
2.57 Nous avons constaté que Santé Canada avait adopté une approche fondée sur les risques afin d’accélérer le traitement des demandes d’homologation reçues au printemps 2020 pour des produits pouvant contribuer à freiner la propagation de la COVID‑19. Le Ministère a instauré provisoirement des mesures efficaces pour répondre à l’urgence de disposer de produits susceptibles de connaître des pénuries, comme les désinfectants pour les mains à base d’alcool. Le Ministère a donné aux fabricants canadiens la flexibilité voulue en les dispensant de se conformer à certaines exigences réglementaires particulières, sans toutefois accroître le risque de problèmes graves liés à l’innocuité des produits. Le Ministère a aussi renforcé sa surveillance des produits mis sur le marché pour lutter contre la COVID‑19.
2.58 Notre analyse à l’appui de cette constatation porte sur :
- l’approche fructueuse d’homologation des désinfectants pour les mains;
- la surveillance proactive de la publicité sur les produits de lutte contre la COVID‑19.
2.59 Cette constatation est importante parce que Santé Canada devait répondre à la demande urgente de produits de lutte contre la COVID‑19 sur le marché, et ce, tout en protégeant les consommateurs.
2.60 Nous n’avons pas présenté de recommandation relativement au secteur examiné.
L’approche fructueuse d’homologation des désinfectants pour les mains
2.61 Au printemps 2020, la pandémie de COVID‑19 a suscité la pénurie de certains produits au Canada, notamment les désinfectants pour les mains à base d’alcool, à même de freiner la propagation du virus. En vue de répondre à la demande urgente pour ces produits, dont certains sont considérés comme des produits de santé naturels, Santé Canada a modifié temporairement la réglementation et les politiques afin d’accélérer l’homologation de ces produits. Les mesures provisoires ont donné aux fabricants canadiens une certaine flexibilité en les dispensant de se conformer à quelques exigences réglementaires pendant une courte période, tout en maintenant l’obligation de diligence raisonnable en matière de sécurité.
2.62 Nous avons constaté que Santé Canada avait fait preuve de diligence raisonnable dans la mise en œuvre de son approche fondée sur les risques pour l’homologation des nouveaux établissements, ce qui a permis de répondre à la demande croissante de désinfectants pour les mains. Même si l’approche du Ministère était réaliste vu les circonstances, nous sommes d’avis que la ministre de la Santé aurait dû prendre un arrêté d’urgence, aux termes de l’article 30.1 de la Loi sur les aliments et drogues, et le déposer au Parlement. Un arrêté d’urgence aurait été le moyen approprié de procéder pour dispenser provisoirement les fabricants de certaines dispositions réglementaires obligatoires et en modifier d’autres. Nous avons noté que le Ministère avait pris des arrêtés d’urgence pour modifier la réglementation concernant d’autres produits de santé utilisés pendant la pandémie de COVID‑19, mais qu’il ne l’avait pas fait pour les produits de santé naturels.
2.63 En avril et en mai 2020, Santé Canada a octroyé plus de 2 500 licences de produits de santé naturels pour des désinfectants pour les mains. Le 13 juillet 2020, le Ministère a annulé certaines des mesures provisoires et repris le processus normal d’homologation, car il disposait alors de preuves confirmant que les fabricants avaient la capacité de répondre à la demande pour l’année à venir.
La surveillance proactive de la publicité sur les produits de lutte contre la COVID‑19
2.64 En avril et en mai 2020, Santé Canada a surveillé de manière proactive la publicité diffusée sur de nombreux types de produits de santé naturels. Le Ministère voulait ainsi avoir l’assurance que la publicité ne prétendait pas que les produits pouvaient atténuer, prévenir, traiter, diagnostiquer ou guérir la COVID‑19. Le Ministère a détecté en tout 80 publicités de ce genre, notamment des allégations qui indiquaient à tort que certains champignons pouvaient prévenir la COVID‑19 et renforcer le système immunitaire, et que l’huile d’origan pouvait empêcher la multiplication de diverses bactéries. Santé Canada a réglé bon nombre de ces cas en communiquant avec les entreprises et en collaborant avec elles pour mettre fin à la diffusion des publicités. Nous avons examiné un échantillon de 25 de ces publicités. Nous avons constaté que 3 d’entre elles étaient toujours diffusées en ligne au moment de l’audit, en dépit des efforts déployés par Santé Canada.
2.65 Pendant que Santé Canada surveillait la publicité en ligne, nous avons aussi effectué des recherches sur les sites Web canadiens en vue de déterminer si certains produits étaient assortis d’allégations de prévention de la COVID‑19 ou de protection contre celle-ci, ou encore d’allégations non autorisées de lutte antivirale. Après avoir examiné 30 sites Web qui diffusaient des publicités pour de tels produits, nous avons constaté que 25 sites diffusaient des allégations non autorisées. Même si le Ministère surveillait activement le marché des produits de lutte contre la COVID‑19, nous avons constaté que beaucoup de produits de santé naturels homologués et non homologués étaient toujours assortis d’allégations non autorisées au moment de notre audit. Or, lorsqu’une pandémie frappe, il est encore plus important que les consommateurs utilisent uniquement des produits qui ont été homologués par Santé Canada. Comme nous l’avons recommandé au paragraphe 2.51, l’adoption d’un programme de surveillance axé sur les risques en vue de repérer les activités non autorisées et de prendre les mesures adéquates permettrait de garantir que de l’information trompeuse n’est pas communiquée aux consommateurs canadiens.
Conclusion
2.66 Nous avons conclu que Santé Canada n’avait pas veillé à ce que les produits de santé naturels offerts aux Canadiennes et aux Canadiens soient sûrs et efficaces, ni veillé à la diffusion d’information exacte sur ces produits, en se fondant sur des preuves appropriées. Le Ministère a certes approuvé les produits en se fondant sur des preuves attestant de leur innocuité et de leur efficacité. Toutefois, sa surveillance des établissements de fabrication et des produits après leur mise sur le marché a exposé les consommateurs à des risques potentiels pour leur santé et leur sécurité, parce que les produits n’étaient pas toujours fabriqués ou commercialisés conformément aux conditions de leur homologation. Même si Santé Canada a fait enquête sur des produits soupçonnés de poser des risques graves pour la santé et pris immédiatement des mesures pour contrer ces risques, l’approche adoptée par le Ministère était réactive. De fait, le Ministère n’a pas toujours réussi à faire retirer les produits du marché.
2.67 Au début de la pandémie de COVID‑19, Santé Canada a rapidement pris des mesures pour homologuer des désinfectants pour les mains à base d’alcool afin de faire face aux pénuries sur le marché. Le Ministère a surveillé de manière proactive les produits de santé naturels assortis d’allégations liées à la COVID‑19 et pris des mesures lorsqu’il s’agissait de fausses allégations. En dépit de la surveillance proactive du Ministère, des allégations non autorisées sur des produits de santé naturels étaient encore diffusées au moment de l’audit.
À propos de l’audit
Le présent rapport de certification indépendant sur les produits de santé naturels a été préparé par le Bureau du vérificateur général du Canada. Notre responsabilité était de donner de l’information, une assurance et des avis objectifs au Parlement en vue de l’aider à examiner soigneusement la gestion que fait le gouvernement des ressources et des programmes et d’exprimer une conclusion quant à la conformité de la surveillance exercée par Santé Canada sur les produits de santé naturels, dans tous ses aspects importants, aux critères applicables.
Tous les travaux effectués dans le cadre du présent audit ont été réalisés à un niveau d’assurance raisonnable conformément à la Norme canadienne de missions de certification (NCMC) 3001 — Missions d’appréciation directe de Comptables professionnels agréés du Canada (CPA Canada), qui est présentée dans le Manuel de CPA Canada — Certification.
Le Bureau du vérificateur général du Canada applique la Norme canadienne de contrôle qualité 1 et, en conséquence, maintient un système de contrôle qualité exhaustif qui comprend des politiques et des procédures documentées en ce qui concerne la conformité aux règles de déontologie, aux normes professionnelles et aux exigences légales et réglementaires applicables.
Lors de la réalisation de nos travaux d’audit, nous nous sommes conformés aux règles sur l’indépendance et aux autres règles de déontologie des codes de conduite pertinents applicables à l’exercice de l’expertise comptable au Canada, qui reposent sur les principes fondamentaux d’intégrité, d’objectivité, de compétence professionnelle et de diligence, de confidentialité et de conduite professionnelle.
Conformément à notre processus d’audit, nous avons obtenu ce qui suit de la direction de l’entité :
- la confirmation de sa responsabilité à l’égard de l’objet considéré;
- la confirmation que les critères étaient valables pour la mission;
- la confirmation qu’elle nous a fourni toutes les informations dont elle a connaissance et qui lui ont été demandées ou qui pourraient avoir une incidence importante sur les constatations ou la conclusion contenues dans le présent rapport;
- la confirmation que les faits présentés dans le rapport sont exacts.
Objectif de l’audit
L’objectif de l’audit consistait à déterminer si Santé Canada avait pris des mesures pour garantir l’innocuité des produits de santé naturels offerts à la population canadienne et la présentation aux consommateurs de renseignements exacts sur ces produits, en se fondant sur des preuves appropriées.
Étendue et méthode
Nous avons examiné le processus d’homologation de Santé Canada pour les produits de santé naturels avant leur mise sur le marché et les activités menées par le Ministère après la mise sur le marché des produits pour surveiller la conformité de l’industrie et détecter les risques et les problèmes associés aux produits. Après le début de la pandémie de COVID‑19, nous avons élargi l’étendue de notre audit pour vérifier également le processus d’homologation et de surveillance des produits liés à la COVID‑19.
Pour le processus d’homologation avant la mise sur le marché des produits, nous avons examiné l’homologation des produits et des établissements de fabrication afin de déterminer si Santé Canada avait obtenu des preuves adéquates qui confirmaient l’innocuité et la qualité des produits, et le fait que l’information présentée sur les produits était exacte, avant la commercialisation des produits. Pour le processus de surveillance postérieure à la mise sur le marché, nous avons examiné si la surveillance exercée par Santé Canada suffisait pour déterminer la conformité de l’industrie au Règlement sur les produits de santé naturels, et si le Ministère avait pris des mesures afin d’atténuer les risques et les problèmes graves pour la santé.
Les éléments suivants ont été exclus de l’audit :
- la préparation de produits de santé naturels par les professionnels de la santé;
- les autres produits de santé, comme les suppléments alimentaires, les produits de consommation, les cosmétiques et les médicaments;
- le classement des produits d’autosoins;
- le Cadre pour les produits d’autosoins;
- les substances figurant à l’annexe 2 du Règlement sur les produits de santé naturels.
Nous avons examiné un échantillon de licences de mise en marché octroyées en 2018 et en 2019, de licences d’établissements (licences d’exploitation) approuvées entre 2017 et 2019 ainsi que leur premier renouvellement de licence, de même qu’un échantillon de risques et de problèmes de santé liés à des produits de santé naturels qui ont été signalés pendant cette période. Nous avons aussi examiné l’approche révisée du Ministère pour homologuer de nouveaux produits et établissements de fabrication de désinfectant pour les mains en avril et en mai 2020 ainsi que les activités de surveillance du marché de Santé Canada au cours de cette période.
Critères
Pour déterminer si Santé Canada avait pris des mesures pour garantir l’innocuité des produits de santé naturels offerts à la population canadienne et la présentation aux consommateurs de renseignements exacts sur ces produits, en se fondant sur des preuves appropriées, nous avons utilisé les critères suivants :
| Critères | Sources |
|---|---|
|
Santé Canada approuve des produits de santé naturels qui sont sûrs et qui ne font pas l’objet de renseignements faux ou trompeurs, en se fondant sur des preuves appropriées. |
|
|
Santé Canada vérifie que les fabricants et les établissements étrangers des importateurs respectent les principales bonnes pratiques de fabrication avant la mise sur le marché canadien de produits de santé naturels. |
|
|
La surveillance exercée par Santé Canada est suffisante pour que le Ministère puisse tirer une conclusion concernant la conformité de l’industrie au Règlement sur les produits de santé naturels, afin de s’acquitter de ses responsabilités réglementaires. |
|
|
Santé Canada surveille les marchés canadiens pour repérer les produits de santé naturels non autorisés et les publicités ou étiquettes de produit qui contiennent des allégations fausses ou trompeuses, ou les deux. |
|
|
Santé Canada prend rapidement des mesures à l’égard des produits de santé naturels non autorisés, des produits homologués dont les étiquettes contiennent des allégations fausses ou trompeuses ou des produits qui posent des risques pour la santé des consommateurs. |
|
Période visée par l’audit
L’audit a porté sur la période allant de février 2017 à décembre 2019 pour tous les critères d’audit. Il s’agit de la période à laquelle s’applique la conclusion de l’audit. Toutefois, afin de mieux comprendre les effets de la pandémie de COVID‑19 sur le marché des produits de santé naturels, nous avons aussi examiné les nouvelles licences de mise en marché de produits et licences d’exploitation octroyées aux établissements en avril et en mai 2020 ainsi que la publicité diffusée en ligne sur les produits de santé naturels pendant ces deux mois.
Date du rapport
Nous avons fini de rassembler les éléments probants suffisants et appropriés à partir desquels nous avons fondé notre conclusion le 3 décembre 2020, à Ottawa, au Canada.
Équipe d’audit
Directrice principale : Heather Miller
Directrice : Lucie Talbot
Erin Brown
Audrey Garneau
Aliya Haji
Ashley Urban
Leendert van Beerschoten
Tableau des recommandations
Le tableau qui suit regroupe les recommandations et les réponses apparaissant dans le présent rapport. Le numéro qui précède chaque recommandation correspond au numéro du paragraphe de la recommandation dans le rapport. Les chiffres entre parenthèses correspondent au numéro des paragraphes où le sujet de la recommandation est abordé.
L’innocuité et l’efficacité des produits de santé naturels
| Recommandation | Réponse |
|---|---|
|
2.26 Santé Canada devrait obtenir :
|
Réponse du Ministère — Recommandation acceptée. Santé Canada reconnaît que ses autorités réglementaires sont limitées et ne permettent pas d’obliger les entreprises à fournir des informations sur la qualité dans le cadre du processus de demande de licence de produit. Les demandeurs sont seulement tenus d’attester que leur produit rencontrera les exigences en termes de qualité. Afin d’améliorer la surveillance de la qualité avant la mise en marché des produits de santé naturels, le Ministère a utilisé des renseignements recueillis dans le cadre de deux projets de surveillance de la conformité et d’un audit sous forme papier des bonnes pratiques de fabrication chez un certain nombre de fabricants. Le Ministère reconnaît également que les produits de santé naturels sont la seule gamme de produits de santé pour laquelle toutes les activités de réglementation sont financées par le public. L’absence d’un cadre de financement stable et les pouvoirs réglementaires limités concernant la qualité ont exercé une pression considérable sur le Ministère pour qu’il exécute ses activités réglementaires et réponde efficacement au nombre et à la complexité scientifique de plus en plus élevés des demandes de licence de produits. Santé Canada va :
|
|
2.35 Santé Canada devrait adopter une approche fondée sur le risque pour les produits de santé naturels homologués mis en vente sur le marché, y compris sur Internet, afin de :
|
Réponse du Ministère — Recommandation acceptée. Santé Canada a commencé à prendre des mesures, par un engagement extensif des parties prenantes et le développement d’un projet de réglementation, pour améliorer l’étiquetage des produits de santé naturels, pour les rendre plus faciles à lire, à comprendre et à comparer avec d’autres produits similaires. Le Ministère va :
|
|
2.47 Santé Canada devrait élaborer un programme de surveillance et d’inspection fondé sur le risque qui établit l’étendue et la fréquence des inspections et qui tient compte des risques liés aux produits, aux établissements et aux problèmes cernés dans le cadre de ses activités de suivi. (2.36 à 2.46) |
Réponse du Ministère — Recommandation acceptée. Santé Canada reconnaît que les produits de santé naturels sont la seule gamme de produits de santé pour laquelle il n’est pas possible d’exiger un rappel ou d’imposer des modalités pour atténuer les risques de sécurité associés à ces produits. Le Ministère a complété un certain nombre de projets de surveillance de la conformité pour recueillir de l’information concernant la surveillance de la qualité des produits de santé naturels, et reconnaît la nécessité d’étendre ses activités à un programme d’inspection plus solide. Santé Canada va :
|
|
2.51 Santé Canada devrait élaborer un programme de surveillance fondé sur les risques qui lui permettrait :
|
Réponse du Ministère — Recommandation acceptée. Santé Canada maintient actuellement un programme basé sur les plaintes pour la surveillance de la conformité réglementaire de la publicité et reconnaît qu’une approche supplémentaire basée sur le risque est nécessaire pour garantir que les activités non autorisées sont prévenues et/ou arrêtées. Le Ministère va :
|
|
2.56 Lorsque des produits sont soupçonnés de poser des risques graves pour la santé, Santé Canada devrait obtenir les renseignements dont il a besoin pour vérifier et garantir que ces produits ne sont plus en vente au Canada. (2.52 à 2.55) |
Réponse du Ministère — Recommandation acceptée. En plus des mesures immédiates que Santé Canada prend déjà pour protéger la santé et la sécurité des Canadiens lorsqu’un risque grave pour la santé est identifié, Santé Canada va :
|

